
Un des premiers problème d'environnement fut celui de l'éventuel diminution de la
couche d'ozone stratosphérique.
Les rayonnements du soleil sont composés de photons qui transportent une énergie h&nu ; la fréquence (&nu) est d'autant plus grande que la longueur d'onde (&lambda) est faible. les UV sont de longueur d'onde faible et donc très énergétique ; ils n'ont pas encore été absorbé dans la stratosphère et peuvent dissocier les molécules d'Oxygène (O2) en deux atomes d'Oxygène (O).
O2 + soleil -> O + O
L'atome se combine alors à la molécule pour donner une molécule d'ozone (O3).
O + O2 -> O3
Qui peut être à son tour photodissociée (photolyse) en O2 et O,
O3 + soleil -> O2 + O
Il s'établit un équilibre O2/O/O3 qui se traduit par une concentration importante d'ozone dans la stratosphère; celle-ci est importante entre 15 et 60 km d'altitude et maximale vers 25 à 30 km.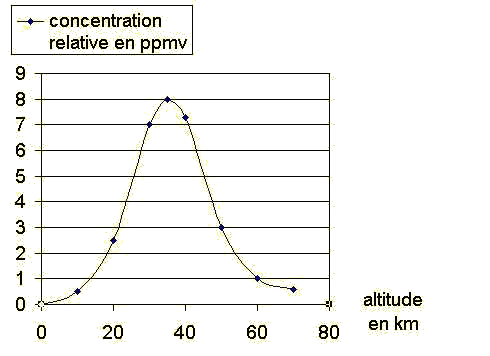 Les molécules d'ozone captent une grande partie du rayonnement solaire ce qui
explique l'augmentation de la température avec l'altitude dans la stratosphère.
Cette couche atmosphérique permet l'absorption des radiations solaires de longueur d'onde
inférieure à 290nm (rayonnement Ultra Violet le plus énergétique). C'est un écran protecteur
indispensable au développement de la vie sur terre.
Les molécules d'ozone captent une grande partie du rayonnement solaire ce qui
explique l'augmentation de la température avec l'altitude dans la stratosphère.
Cette couche atmosphérique permet l'absorption des radiations solaires de longueur d'onde
inférieure à 290nm (rayonnement Ultra Violet le plus énergétique). C'est un écran protecteur
indispensable au développement de la vie sur terre.

Ozone stratosphérique ; Photolyse de l'ozone.
Ozone stratosphérique ; Conséquences, bilan.
Plan du site N&E Introduction.
Les rayonnements du soleil sont composés de photons qui transportent une énergie h&nu ; la fréquence (&nu) est d'autant plus grande que la longueur d'onde (&lambda) est faible. les UV sont de longueur d'onde faible et donc très énergétique ; ils n'ont pas encore été absorbé dans la stratosphère et peuvent dissocier les molécules d'Oxygène (O2) en deux atomes d'Oxygène (O).
O2 + soleil -> O + O
L'atome se combine alors à la molécule pour donner une molécule d'ozone (O3).
O + O2 -> O3
Qui peut être à son tour photodissociée (photolyse) en O2 et O,
O3 + soleil -> O2 + O
Il s'établit un équilibre O2/O/O3 qui se traduit par une concentration importante d'ozone dans la stratosphère; celle-ci est importante entre 15 et 60 km d'altitude et maximale vers 25 à 30 km.
 Les molécules d'ozone captent une grande partie du rayonnement solaire ce qui
explique l'augmentation de la température avec l'altitude dans la stratosphère.
Cette couche atmosphérique permet l'absorption des radiations solaires de longueur d'onde
inférieure à 290nm (rayonnement Ultra Violet le plus énergétique). C'est un écran protecteur
indispensable au développement de la vie sur terre.
Les molécules d'ozone captent une grande partie du rayonnement solaire ce qui
explique l'augmentation de la température avec l'altitude dans la stratosphère.
Cette couche atmosphérique permet l'absorption des radiations solaires de longueur d'onde
inférieure à 290nm (rayonnement Ultra Violet le plus énergétique). C'est un écran protecteur
indispensable au développement de la vie sur terre.

- Micro ondes, entre 1 mm et 10 mm, 10-3 à 10-2
- IR, entre 700 nm et 1 mm, 0.7 10-6 à 10-3
- Visible, entre 400 et 700 nm, 0,4.10-6 à 0,7.10-6
- UV-A, entre 320 et 400 nm, 0,4.10-6
- UV-B, entre 280 et 320 nm
- UV-C, entre 200 et 280 nm, 10-8
- Rayons X, entre 10 pm et 200 nm, 10-11 à 10-8
Ozone stratosphérique ; Photolyse de l'ozone.
Ozone stratosphérique ; Conséquences, bilan.
Plan du site N&E Introduction.