
NO2 + soleil -> NO + O
L'oxygène atomique réagit alors avec la molècule d'oxygène pour former de l'ozone :
O2 + 0 -> O3
L'ozone ainsi formé peut alors oxyder le monoxyde d'azote en dioxyde d'azote:
NO + O3 -> N02 + O2
On obtient ainsi un équilibre N02/N0/03. Tant qu'il subsiste du monoxyde d'azote, l'ozone est piégé.
La concentration d'ozone ainsi formée est très faible car il est aussitôt consommé dans la réaction. Il éxiste donc d'autres moyen pour oxyder NO en N02 :
1. Les radicaux libres tels que les radicaux peroxyle (R02). Citons par exemple
le radical hydroperoxyle (H02) obtenu lors de l'oxydation des hydrocarbures.
2. L'ozone troposphérique peut être photolisé et donner naissance à
de l'oxygène moléculaire et de l'oxygène atomique. Ce dernier est très instable et réagit avec la
vapeur d'eau pour former des radicaux libres OH, appelés radicaux hydroxyle.
O3 + soleil -> O2 + O
o + H2O -> 2OH
3. Un autre agresseur possible est le radical nitrate (N03) ; il est formé par réaction
du dioxyde d'azote avec l'ozone.
NO2 + O3 -> N03 + O2
Le radical nitrate se forme de nuit, lorsqu'il n'y a plus de rayonnement solaire susceptible de
photo-dissocier l'ozone.
Formation de l'ozone troposphérique :
par des composés carbonés : oxyde de carbone (CO), le méthane (CH4)...
par des composés azotés : NO/NO2,
sources et puits de l'ozone troposphérique :
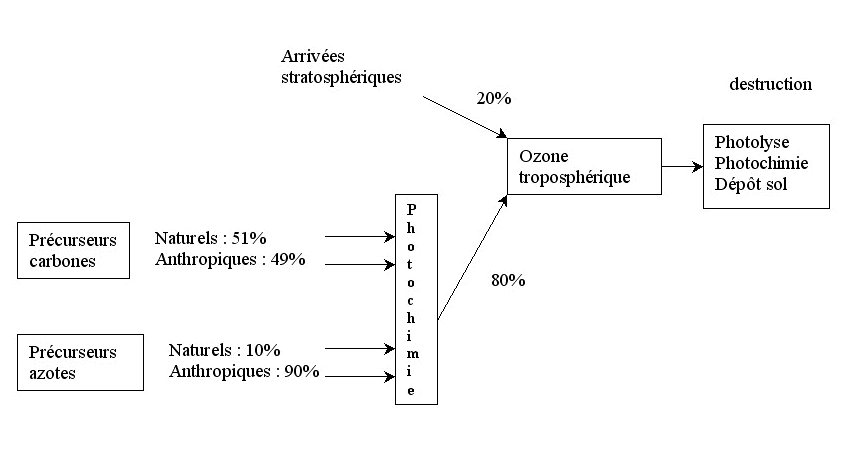
Ozone troposphérique ; Bilan et évolution.
Ozone troposphérique ; Le rôle des oxydes d'azote NOx.
Plan du site N&E Introduction.